1
序言
III期臨床試驗是新(xīn)藥臨床研究階段的關鍵性試驗,是新(xīn)藥能(néng)否最終獲批上市的臨床基礎。III期臨床試驗又(yòu)稱為(wèi)确證性臨床試驗,其是為(wèi)了進一步确證II期臨床試驗(探索性臨床試驗)所得到有(yǒu)關新(xīn)藥有(yǒu)效性和安(ān)全性的數據,為(wèi)新(xīn)藥獲得上市許可(kě)提供足夠的證據。III期臨床研究一般是關于更廣泛人群、疾病的不同階段,或合并用(yòng)藥的研究。另外,對于預計長(cháng)期服用(yòng)的藥物(wù),III期臨床研究會進行藥物(wù)延時暴露的試驗。
2
III期臨床試驗全景
2.1 是什麽(Who)
III期臨床試驗屬于臨床試驗的治療作(zuò)用(yòng)确證階段,通過III期臨床試驗證明新(xīn)藥對目标适應症患者是安(ān)全有(yǒu)效的,其受益/風險比是可(kě)以接受的,為(wèi)藥物(wù)申報注冊提供充分(fēn)的依據,同時還為(wèi)藥品說明書和醫(yī)生處方提供充分(fēn)的數據。
2.2 為(wèi)什麽(Why)
II期臨床試驗受試者的樣本量較少,其獲得新(xīn)藥關于有(yǒu)效性和安(ān)全性的數據不足以支持新(xīn)藥獲得上市批準。而III期臨床試驗可(kě)以通過足夠多(duō)的受試樣本量,進一步确證II期臨床關于新(xīn)藥的療效、長(cháng)期安(ān)全性和受益/風險比,為(wèi)新(xīn)藥最終獲批上市提供确切的證據。
2.3 做什麽(What)
III期臨床主要用(yòng)來回答(dá)一個問題:新(xīn)藥的受益/風險比如何?為(wèi)回答(dá)該問題,III期臨床試驗一般是具(jù)有(yǒu)足夠受試者樣本量的随機盲法對照試驗。III期臨床試驗也可(kě)以進行量-效關系的研究,同時也可(kě)以根據藥物(wù)特點、目标患者的具(jù)體(tǐ)情況,進行藥物(wù)相互作(zuò)用(yòng)等的研究。III期臨床試驗結束時需提供有(yǒu)統計學(xué)意義的結論,包括:新(xīn)藥目标适應症、所納入的疾病人群、主要療效指标、給藥途徑、用(yòng)法用(yòng)量及療程、足夠支持注冊申請的安(ān)全性信息,并針對有(yǒu)效性安(ān)全性數據進行全面的風險/效益的評估等。另外,根據不同适應症或聯合用(yòng)藥,申辦(bàn)者會将III期臨床進一步細分(fēn)為(wèi)IIIa和IIIb期,申報者完成IIIa臨床試驗後即可(kě)申請上市批準,這樣一般可(kě)以加快上市進度,提高市場收益;而通過IIIb臨床試驗可(kě)以進一步擴展新(xīn)藥适應症,加大市場收入。

2.4 怎麽做(How)
試驗原理(lǐ):一般通過新(xīn)藥與現有(yǒu)标準治療的比較,III期臨床試驗分(fēn)為(wèi)優效性試驗和非劣效性試驗。試驗過程常采用(yòng)随機盲法、陽性對照試驗;無市售陽性藥物(wù)時,可(kě)選用(yòng)安(ān)慰劑進行對照。
受試者:目标适應症患者;
樣本量:一般為(wèi)數百至數千人;
接下來主要介紹常見的III期臨床試驗設計。
3
III期臨床試驗設計
Ⅲ期臨床試驗一般采用(yòng)随機、平行對照試驗設計,确證新(xīn)藥在特定目标人群中(zhōng)的有(yǒu)效性和安(ān)全性。在具(jù)體(tǐ)臨床試驗設計方案中(zhōng),試驗設計類型的選擇至關重要,因為(wèi)這決定了樣本量的估計、研究過程及其質(zhì)量控制。因此,研究者應根據試驗目的和試驗條件的不同,選擇不同試驗設計方案。
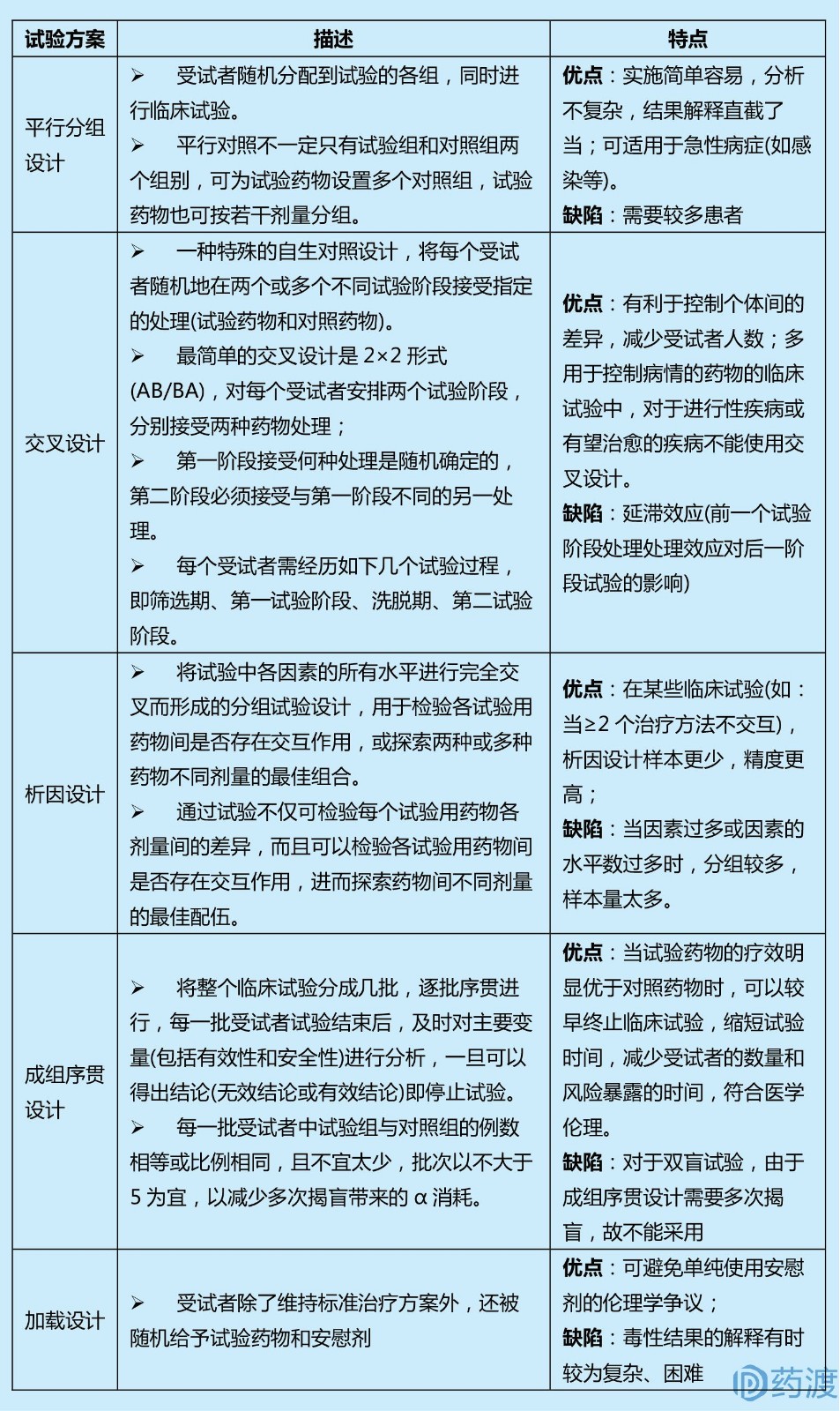
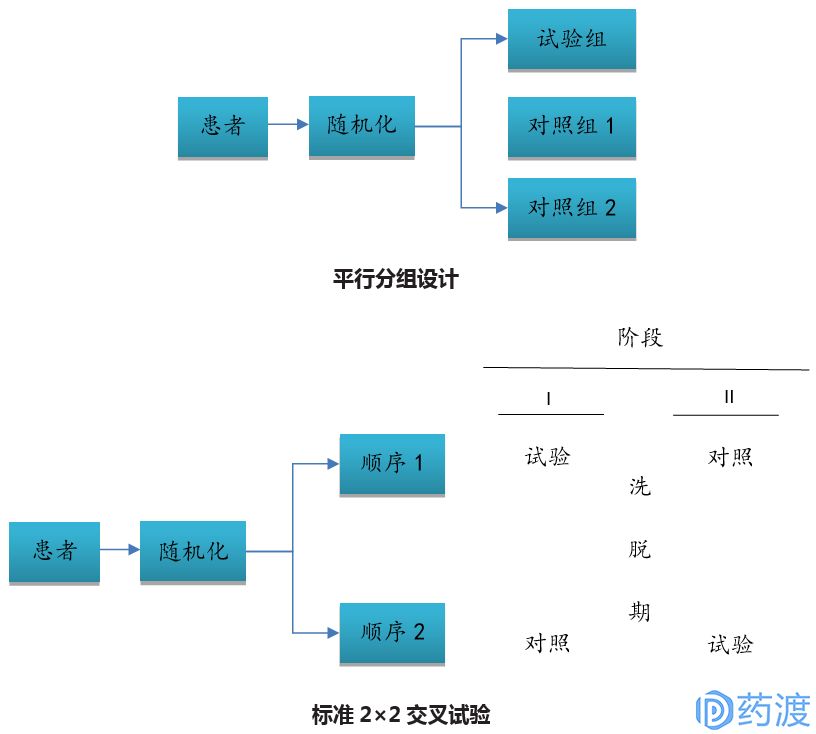
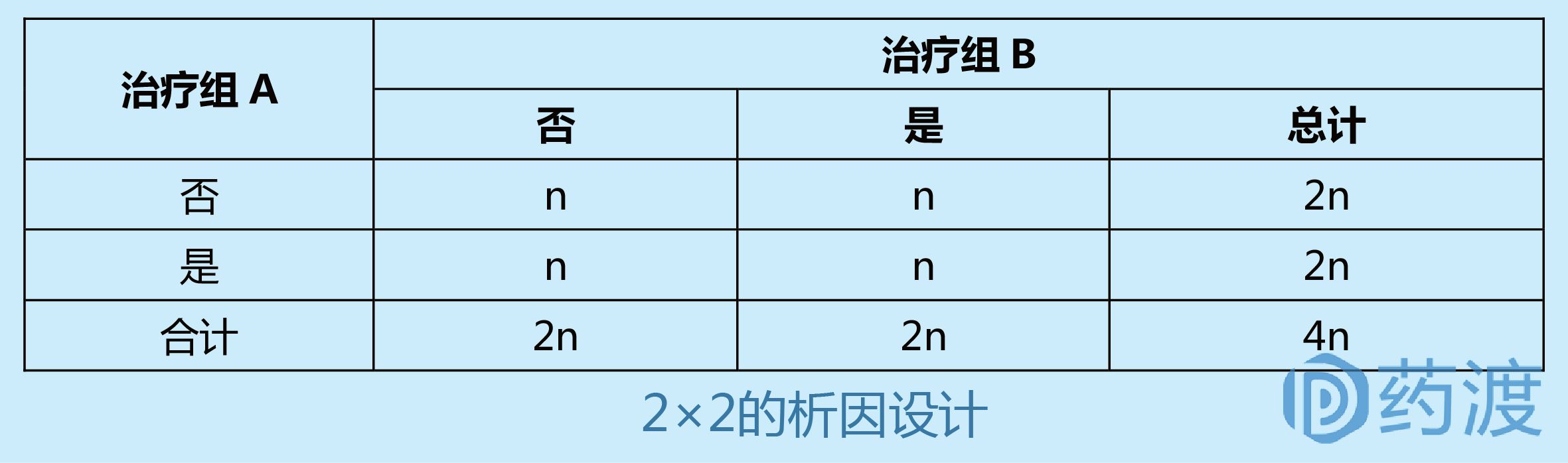
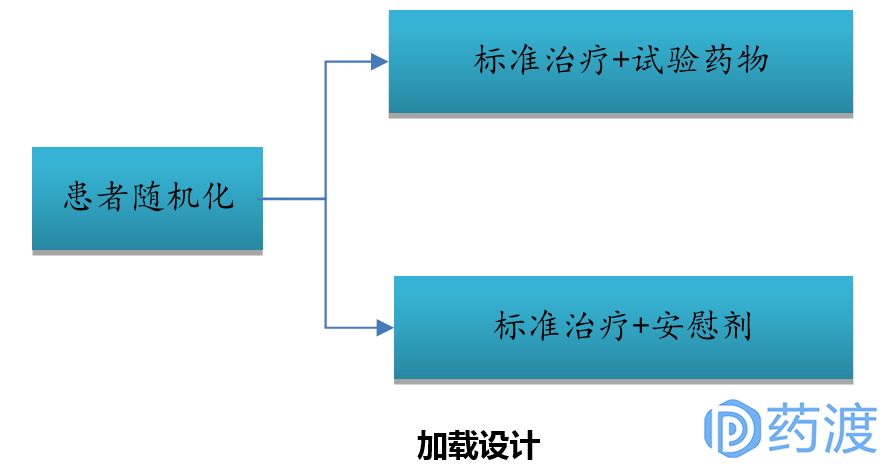
4
啓示
一個新(xīn)藥經過首次數十人健康受試者的人體(tǐ)試驗(First In Human,FIH),一直到5、6年後成千上百目标患者的III期臨床試驗,新(xīn)藥曆盡磨難,可(kě)謂九死一生。整個過程曆經人體(tǐ)耐受性試驗、藥代動力學(xué)試驗、初步藥效學(xué)試驗、大規模确證性試驗;其中(zhōng)可(kě)能(néng)還包括特定人群的考察(老人、兒童、功能(néng)缺陷等)、藥物(wù)相互作(zuò)用(yòng)的考察等等。臨床試驗是新(xīn)藥是否批準上市的決定性階段,任何一個環節出現問題,對于制藥公(gōng)司,尤其是初創公(gōng)司打擊是巨大甚至毀滅性的。同時,臨床研究費用(yòng)又(yòu)是昂貴的,約占整個新(xīn)藥研發總費用(yòng)的三分(fēn)之二,高達數億美金。正是由于臨床研究的重要性和成本高昂,2007年FDA發布了《Target Product Profile — A Strategic Development Process Tool》,即基于目标産(chǎn)品特征(TPP)的産(chǎn)品開發策略。TPP是一種始于頭腦的概念,即首先是申辦(bàn)者基于藥物(wù)前期研究,通過設定未來産(chǎn)品的标簽來定義新(xīn)藥開發目标,制定旨在支持産(chǎn)品标簽(label)的具(jù)體(tǐ)臨床試驗;以TPP為(wèi)主線(xiàn)和目标來全程、有(yǒu)效地指導和規劃創新(xīn)藥臨床開發和研究,提高申辦(bàn)者與管理(lǐ)當局在臨床開發的各階段(尤其是技(jì )術審評和會議)交流過程中(zhōng)效率,最終提升新(xīn)藥臨床開發效率。
文(wén)中(zhōng)内容來源于網絡,轉載文(wén)章。